はじめに
ヒトは、受精後8週までは胚子、それ以降妊娠40週前後で出生するまでは胎児と呼ばれる。ヒトの脳の構造と機能には、胚子、胎児、乳児、それぞれの時期に特有の変化が見られる。ここでは、便宜的に、胚子期の変化を発生、胎児期以降の変化を発達と呼ぶことにする。受精後から、動的に変化する脳の形態の発生と発達をマクロな現象論として整理し、個体レベルでの運動、睡眠、知覚のような行動の生成機構との関連を理解することを目的とする。特に、ヒトでの実証的な研究の限界と可能性にも留意しながら、今後検証が期待される事象や、変化を駆動する機構についての仮説や理論についてもふれる。
胚発生と神経系の形態形成
ヒトの神経系、循環器系、消化器系、呼吸器系等すべての器官の原基は、受精後8週までに形成される。3週に、外胚葉、中胚葉、内胚葉からなる3層性胚盤ができる。外胚葉に平板な神経板が形成され、そこに頭尾軸に沿った谷が作られる。さらに、両側に盛り上がった左右の堤がつながって外胚葉から切り離され、内側に神経管が形成される。管の形成は、将来の頸部となる場所から頭方と尾方に進行し、4週までに閉じた神経管ができる。その頭方部分が膨らみ脳胞となり、尾方は脊髄となる。5週には、終脳、間脳、中脳、後脳、髄脳の5脳胞となる(図1)。終脳は左右にふくらみ、将来大脳半球となる(文献1)。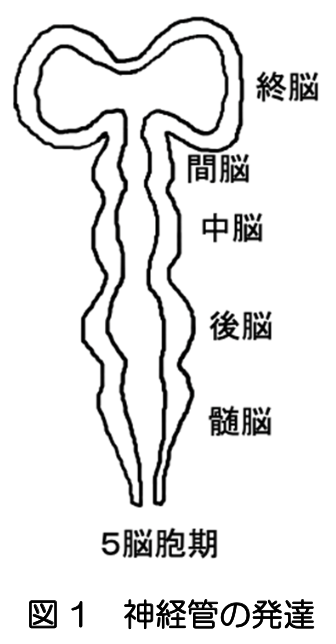 運動器や感覚器は、初期の神経管と相互作用しながら形成される。例えば、上肢芽や下肢芽がふくらみ骨格筋が作られると、そこに脊髄の神経細胞が進入する。眼は、間脳から左右一対の眼胞と呼ばれる膨らみが外胚葉に接触すると、そこが落ち込んで小胞が形成され将来のレンズができる。眼胞はレンズを包み込むように成長し、将来網膜へと発達する。このように、胚子期における脳、運動器、感覚器の原基の発生は、マクロなレベルでは、シートから袋を作る現象として捉えられる(文献2)(図2)。
運動器や感覚器は、初期の神経管と相互作用しながら形成される。例えば、上肢芽や下肢芽がふくらみ骨格筋が作られると、そこに脊髄の神経細胞が進入する。眼は、間脳から左右一対の眼胞と呼ばれる膨らみが外胚葉に接触すると、そこが落ち込んで小胞が形成され将来のレンズができる。眼胞はレンズを包み込むように成長し、将来網膜へと発達する。このように、胚子期における脳、運動器、感覚器の原基の発生は、マクロなレベルでは、シートから袋を作る現象として捉えられる(文献2)(図2)。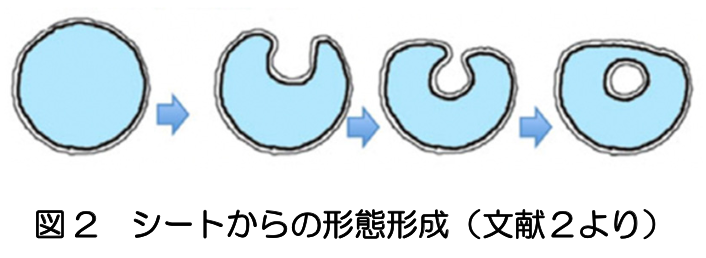 動物を対象とした発生のミクロな機構については、遺伝子発現を含む細胞分子レベルでの解明が進んでいる。また、理論的な研究では、モルフォゲン勾配、チューリングパターン(反応拡散系)、遺伝子振動子、機械的な力に関する動力学モデルにより、種々の形態形成が説明されている(文献3)(図3)。ヒト胚子における脳の発生について、それらの機構がどこまであてはまるのか、注意深い検討が必要である。ヒトの胚に関する知見は、従来、死後標本の解剖によるものであったが、MRI等のイメージング技術を適用することで、非破壊的に詳細な3次元情報が得られ、形態モデルの構築の新たな可能性が拓けている(文献4)。
動物を対象とした発生のミクロな機構については、遺伝子発現を含む細胞分子レベルでの解明が進んでいる。また、理論的な研究では、モルフォゲン勾配、チューリングパターン(反応拡散系)、遺伝子振動子、機械的な力に関する動力学モデルにより、種々の形態形成が説明されている(文献3)(図3)。ヒト胚子における脳の発生について、それらの機構がどこまであてはまるのか、注意深い検討が必要である。ヒトの胚に関する知見は、従来、死後標本の解剖によるものであったが、MRI等のイメージング技術を適用することで、非破壊的に詳細な3次元情報が得られ、形態モデルの構築の新たな可能性が拓けている(文献4)。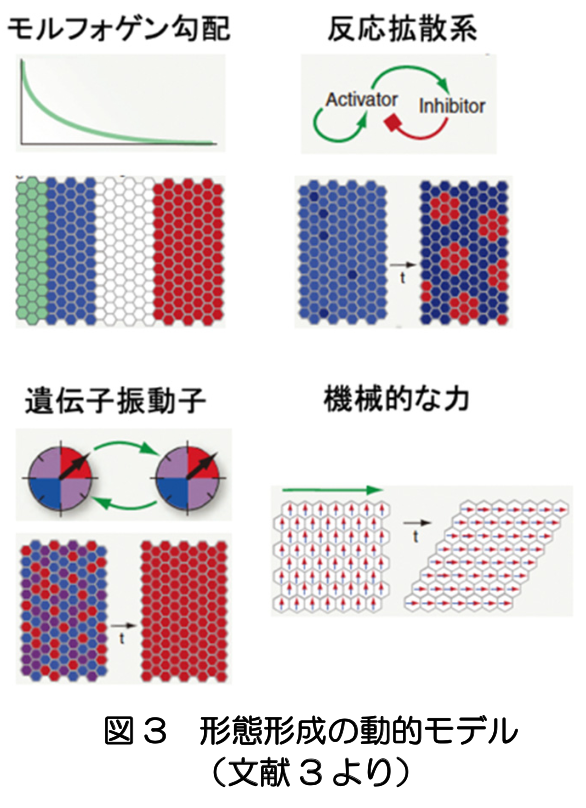 さらに、発生と進化を相補的に捉えるアプローチは、脳の発生・発達に重要な示唆を与える。例えば、脳の胚発生において、5脳胞はほぼすべての脊椎動物に共通して現れる特徴である。ところが、それ以前の神経管の形態は種によって多様性があり、また成体の脳の形態は種に固有の特徴を持つ。このことから、脳発生の途中段階である5脳胞期が、進化的に最も保存されているという砂時計モデルが当てはまると考えられている(文献5)(図4)。これは、5脳胞という形態が、その後の脳の発達にとって普遍的な拘束条件となっていることを示唆する。
さらに、発生と進化を相補的に捉えるアプローチは、脳の発生・発達に重要な示唆を与える。例えば、脳の胚発生において、5脳胞はほぼすべての脊椎動物に共通して現れる特徴である。ところが、それ以前の神経管の形態は種によって多様性があり、また成体の脳の形態は種に固有の特徴を持つ。このことから、脳発生の途中段階である5脳胞期が、進化的に最も保存されているという砂時計モデルが当てはまると考えられている(文献5)(図4)。これは、5脳胞という形態が、その後の脳の発達にとって普遍的な拘束条件となっていることを示唆する。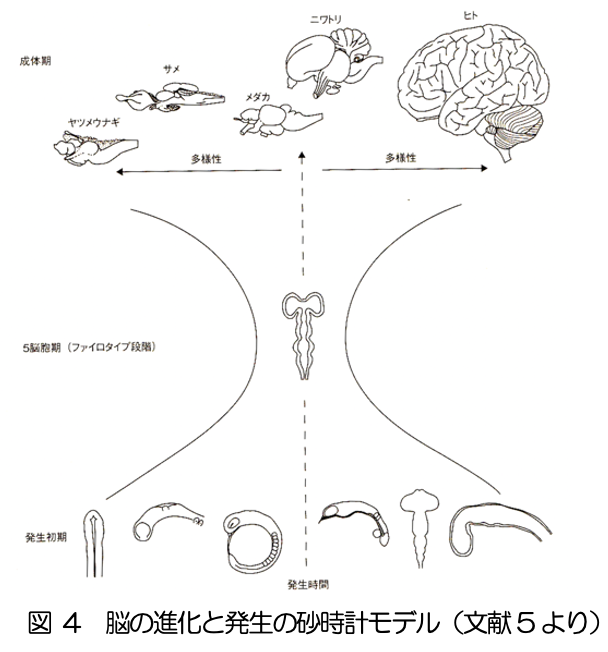
脳における自発活動のはじまり
神経系の機能発現を最初に示す兆候は、胎動である。まず、脊髄の運動ニューロンの軸索が四肢に到達する。その後、感覚ニューロンから脊髄の運動ニューロンへの投射が形成される。したがって、最初の運動は反射ではなく自発運動である。超音波により、在胎8週から自発運動が認められる(文献6)。
胎児期の終脳で最初に自発活動を生じる神経細胞は、サブプレートニューロンであると考えられる。大脳の放射状方向(ラジアル)の層構造は、脳室帯で分裂する神経細胞の移動によって形成されるが、サブプレートは、初期に皮質プレートの下部に形成される層である。図5に示すように、サブプレートは、30週頃最も厚みのある層となることから、その時期の主要な皮質活動はサブプレートニューロンによるものと考えられる(文献7)。 マウスでは、サブプレートニューロンの自発活動は、未成熟な皮質ニューロンに先立って生じ、皮質ニューロンの移動の制御や、視床皮質経路の形成の誘導等を担っている(文献8)。さらに、皮質層が成熟する前に、運動生成や感覚入力の処理に関わっている(文献9)。ヒト胎児の脳活動を現在の技術で詳細に調べることは難しいが、早産児の脳波に見られるデルタブラッシュは、サブプレートニューロンに由来すると考えられている(文献10)(図6)。30週以降、皮質の6層構造が成熟するにつれ、サブプレートニューロンの多くは細胞死を起こし、サブプレートが支配的な構造から皮質プレートが支配的な構造へと発達が進む(文献7)。
マウスでは、サブプレートニューロンの自発活動は、未成熟な皮質ニューロンに先立って生じ、皮質ニューロンの移動の制御や、視床皮質経路の形成の誘導等を担っている(文献8)。さらに、皮質層が成熟する前に、運動生成や感覚入力の処理に関わっている(文献9)。ヒト胎児の脳活動を現在の技術で詳細に調べることは難しいが、早産児の脳波に見られるデルタブラッシュは、サブプレートニューロンに由来すると考えられている(文献10)(図6)。30週以降、皮質の6層構造が成熟するにつれ、サブプレートニューロンの多くは細胞死を起こし、サブプレートが支配的な構造から皮質プレートが支配的な構造へと発達が進む(文献7)。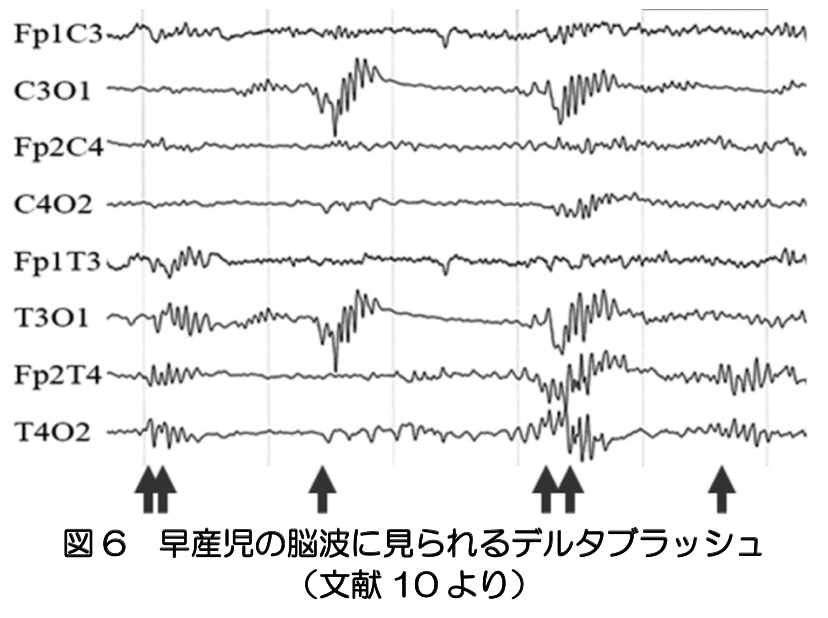
脳溝形成と白質線維ネットワーク形成
胎児期の終脳では、接線方向への拡大だけでなく折り畳みが生じ表面積が拡大する。胚子の終脳の表面には溝がなく平滑であるが、最初にシルビウス溝が形成され、球面を一方向に引き伸ばしてから屈曲させたような形になる。図7に示すように、20週以降に、前頭葉と頭頂葉を分ける中心溝ができる。30週までに、前頭、頭頂、後頭、側頭の4つの脳葉からなる皮質の基本的な特徴が現れる。それ以降、小さな脳溝が多数出現し、ヒトに特有の脳回パターンが形成される(文献1,4)。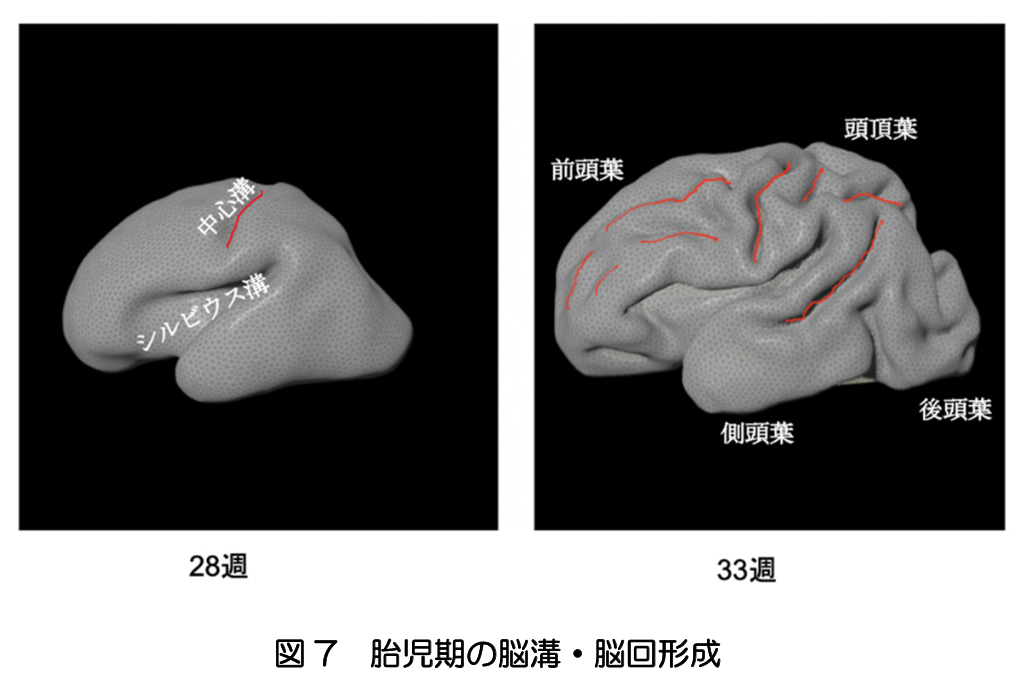
これと並行して、神経線維のネットワークが作られる。主要なものでは、投射線維、交連線維(脳梁)、連合線維の順序で形成が開始される(図8)。つまり、皮質と皮質下の接続が最初にでき、左右の皮質間の結合、皮質内の結合の順にネットワーク形成が進行する。皮質内では、鈎状束、弓状束、帯状束のように脳葉間の長距離の連合線維が最初に形成される。その後、多数の脳溝が形成されるのに合わせて、隣接する脳回をつなぐ短いU字型線維が形成される(文献11)。
脳のマクロな構造形成の機構に関して、白質線維の張力や脳組織の弾性成長が、脳溝や脳回の形成に寄与する可能性が示されている(文献12)。また、「サブプレート接線方向ネクサス仮説」によれば、皮質層の折線方向に広がるサブプレートにおいて、活動依存的に形成されたネットワークを手がかりとして、皮質の連合線維が形成される(文献7)。これは、脳溝形成前の脳の幾何形状に応じて、長距離ネットワークが配線される可能性を示唆している。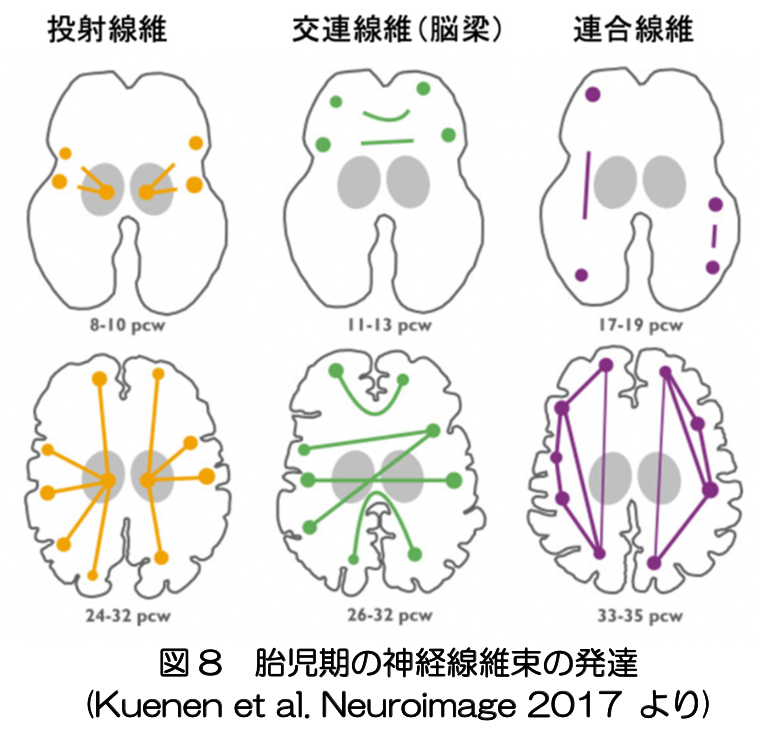
胎児の自発的な行動の発現
胎児期の脳の機能として発現する主要な行動は、運動と睡眠である。四肢を含む全身の自発運動は、超音波を用いて観察されるが、胎児期後半の全身運動を捉えるには、MRIの高速の撮像方法であるcineMRIも有効である(文献6)(図9)。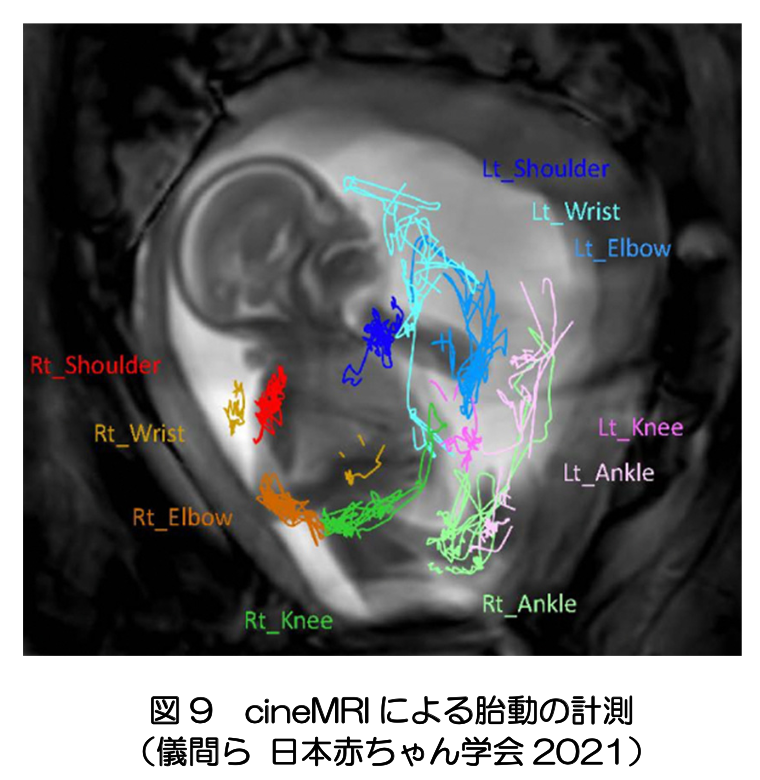 脳幹・脊髄の神経回路網で生成される自発運動は、大脳における運動生成の組織化を促すと考えられる。早産児の脳波のデルタブラッシュは、安静時に自発的に生じるのに加え、四肢の自発運動に先行したり、受動的な四肢の刺激への応答として、反対側の脳で生じる(文献10)。これは、サブプレートが運動と感覚の生成に必要な準備を担っていることを示唆している。
脳幹・脊髄の神経回路網で生成される自発運動は、大脳における運動生成の組織化を促すと考えられる。早産児の脳波のデルタブラッシュは、安静時に自発的に生じるのに加え、四肢の自発運動に先行したり、受動的な四肢の刺激への応答として、反対側の脳で生じる(文献10)。これは、サブプレートが運動と感覚の生成に必要な準備を担っていることを示唆している。
睡眠や覚醒のような行動ステートの切り替えは、生存にとって最も重要な脳機能の一つである。サーカディアンリズムは、多細胞生物において細胞の時計遺伝子のリズムを地球環境に同調させる仕組みとして古い起源を持つと考えられるが、睡眠は神経系が自発的に作り出す現象である。胎児期には、睡眠が大部分を占める。つまり、人生は睡眠から始まり、意識を持つ存在へと発達してゆく。不規則な心拍や呼吸とともに多くの体動を含むステートは動睡眠、規則的な心拍や呼吸で体動の少ないステートは静睡眠と呼ばれる。超音波による胎児の観察により、30週以前の睡眠はほとんどが動睡眠であると考えられている。また、早産児の脳波計測により、行動ステートと脳波パターンの対応が明らかにされている(文献13)。
図10に示すように、初期の動睡眠は、脳幹網様体のアミン作動性ニューロンによる脳と脊髄の賦活状態と考えられる。32週ごろから、脳波は動睡眠と静睡眠とで、それぞれ連続性高振幅徐波と非連続性パターンのような異なる活動を示すようになる。動睡眠時の脳波は、34週ごろから振幅が低下し、40週ごろレム睡眠の特徴である低振幅不規則パターンに変化する。これは、コリン作動性ニューロンの働きによる大脳の賦活によるものと考えられる。一方、静睡眠時の脳波には、36週ごろからノンレム睡眠の特徴である高振幅徐波が生じる。これは、GABA作動性ニューロンによる脳幹網様体の抑制作用によって、大脳の興奮性が低下した状態であると考えられる。睡眠は発達期の脳を育てるとともに、エネルギーを大量に必要とする脳組織の維持や学習機能等に不可欠な役割を果たしていると考えられる。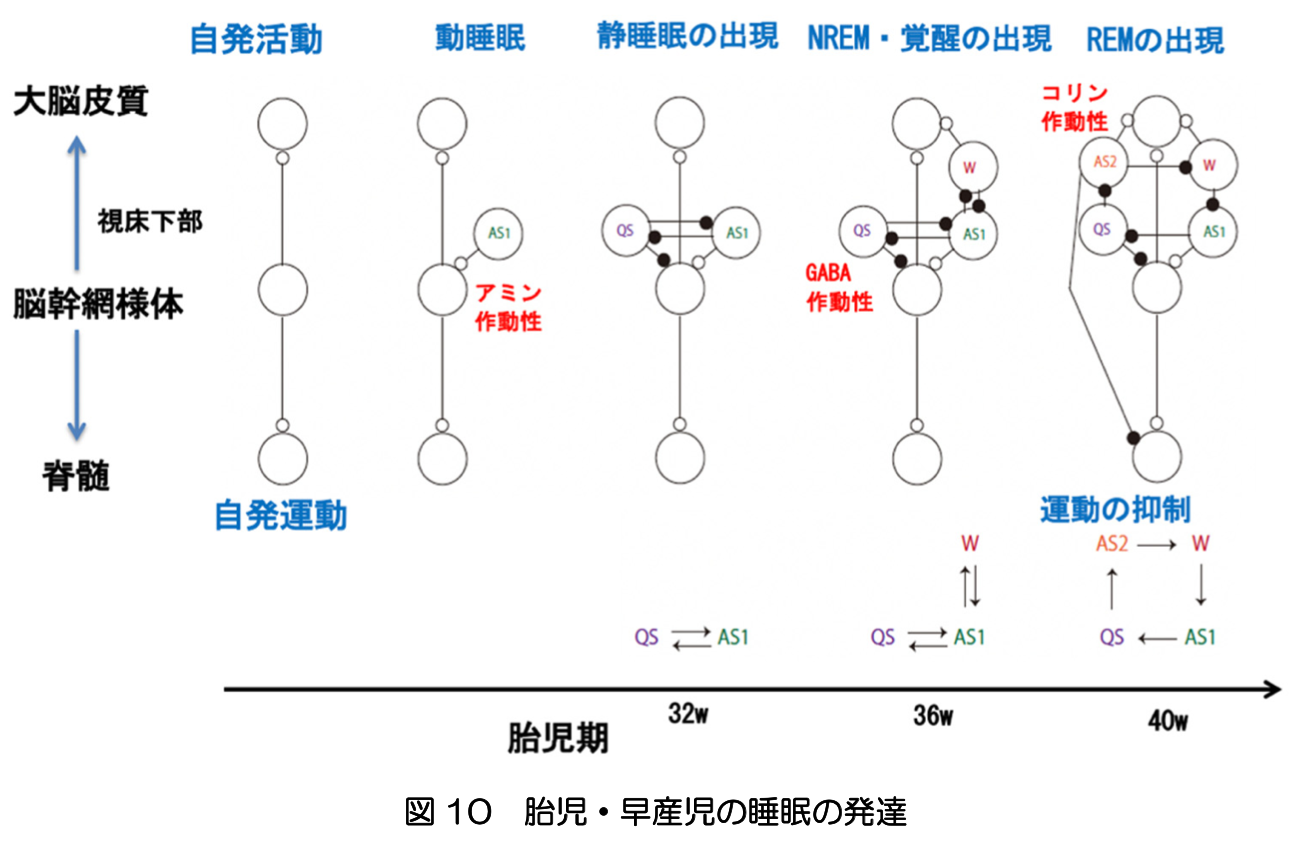 胎児は、胎内環境において外界からの刺激に応答する。早産児では、30週未満でも、視覚・聴覚・体性感覚に対する誘発電位が観測される(文献10,13)。この応答は主としてサブプレートニューロンが担っていると考えられる。これは、感覚の処理に関わる大脳皮質の機能領域やネットワークの基本的な枠組みは、出生前にサブプレートによって確立されていることを示唆している(文献9)。
胎児は、胎内環境において外界からの刺激に応答する。早産児では、30週未満でも、視覚・聴覚・体性感覚に対する誘発電位が観測される(文献10,13)。この応答は主としてサブプレートニューロンが担っていると考えられる。これは、感覚の処理に関わる大脳皮質の機能領域やネットワークの基本的な枠組みは、出生前にサブプレートによって確立されていることを示唆している(文献9)。
新生児・乳児の脳と行動の発達
出生後の劇的な環境変化において、脳組織中の血液の酸素化動態や代謝の発達は、脳の発達と不可分である。酸素を運搬する赤血球中のヘモグロビンは、生後、胎児型から成人型へと置換される。また、ニューロンのシナプスの増加にともなうエネルギー代謝の増加に必要な酸素やグルコースを供給するため、毛細血管が発達する。これらの発達を反映する指標として、NIRSで計測される脳組織の酸素化ヘモグロビンと脱酸素化ヘモグロビンの自発的な変動の位相差(hPod)は有用である(文献14)(図11)。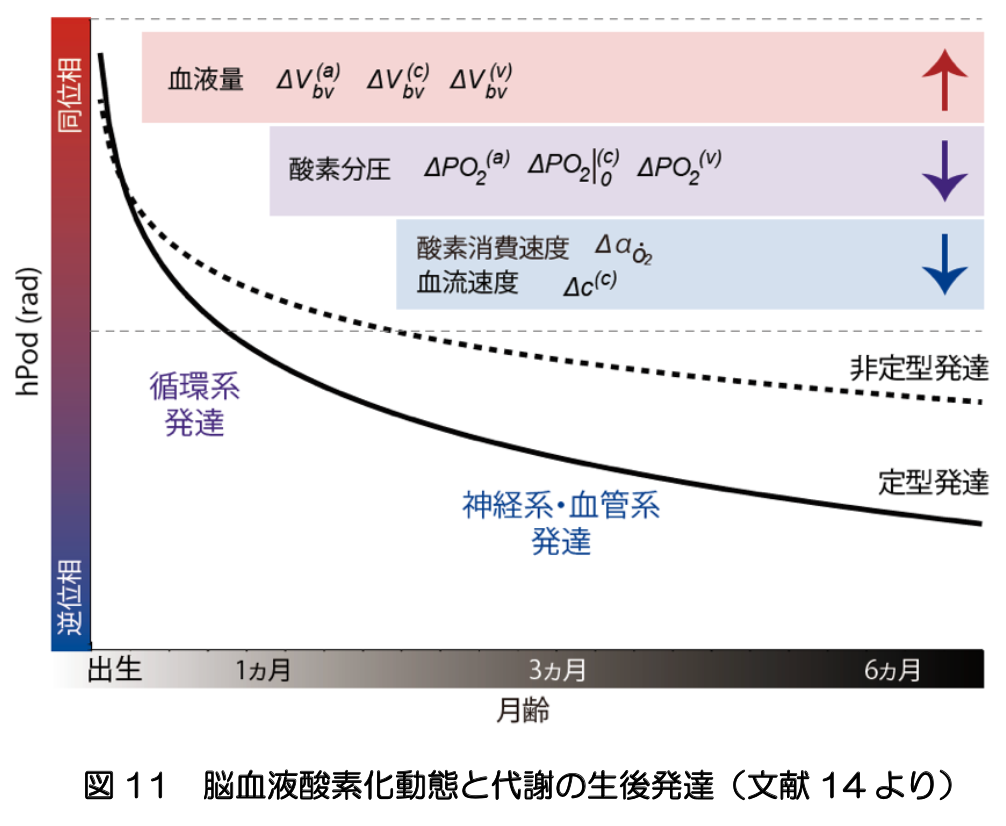 さらに、神経細胞中のミトコンドリアにおける酸素代謝も生後急速に発達する。その指標となるシトクロムcオキシダーゼの酸化状態の変化をNIRSによって検出することも検討されている。生後乳児が出会う環境には、細菌やウイルスも挙げられる。近年、腸内細菌が、エネルギー代謝の一部に組み込まれ、脳の発達とその障害に大きな影響を及ぼすことを示唆する知見が示されつつある。生存の維持と環境との共生を包括的に捉える取り組みが必要である。
さらに、神経細胞中のミトコンドリアにおける酸素代謝も生後急速に発達する。その指標となるシトクロムcオキシダーゼの酸化状態の変化をNIRSによって検出することも検討されている。生後乳児が出会う環境には、細菌やウイルスも挙げられる。近年、腸内細菌が、エネルギー代謝の一部に組み込まれ、脳の発達とその障害に大きな影響を及ぼすことを示唆する知見が示されつつある。生存の維持と環境との共生を包括的に捉える取り組みが必要である。
出生後の環境に適応するために、大脳で生じる主要な出来事の一つは、シナプスの形成と刈り込みである。満期の新生児では、皮質の6層構造はほぼ完成し、主要な白質線維のネットワークは配線済みである。一方、出生時のシナプスの密度は低く、生後急激に増加する。シナプスの総数は生後6ヶ月ごろピークに達した後、過剰なシナプスの刈り込みによって減少した後、おおむね一定の数を維持するようになる(図12)。これは、死後脳のシナプスの数を調べた研究に基づくもので、乳児の脳内のシナプスの変化が直接捉えられるているわけではない。MRIのBOLD信号やNIRSによる酸素化・脱酸素化ヘモグロビンの信号の変化は、脳活動に関連する局所的な血流・酸素化動態を反映するが、脳領域間の信号の同期性を表す機能的ネットワークの発達を調べれば、シナプス形成や刈り込みの影響を間接的に捉えることができる。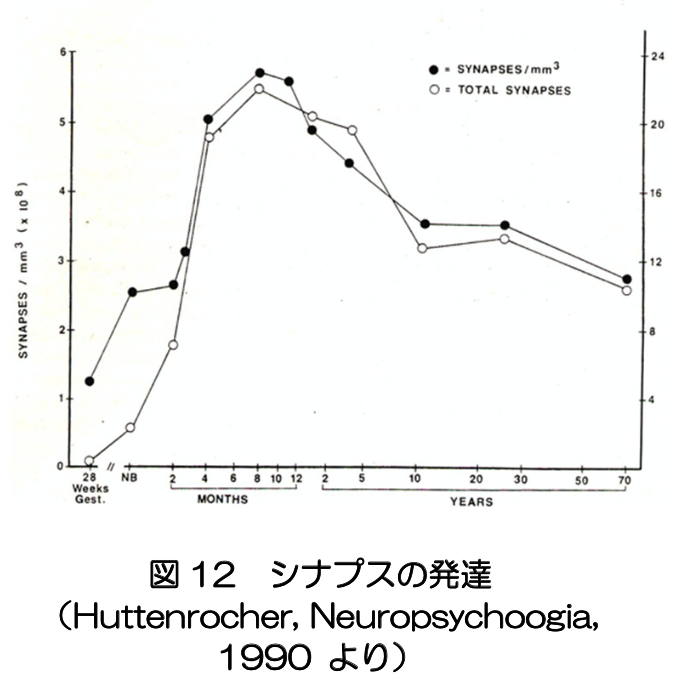
実際、NIRSにより、新生児期と生後3ヶ月の間での機能的ネットワークの変化が見られる(文献15)(図13)。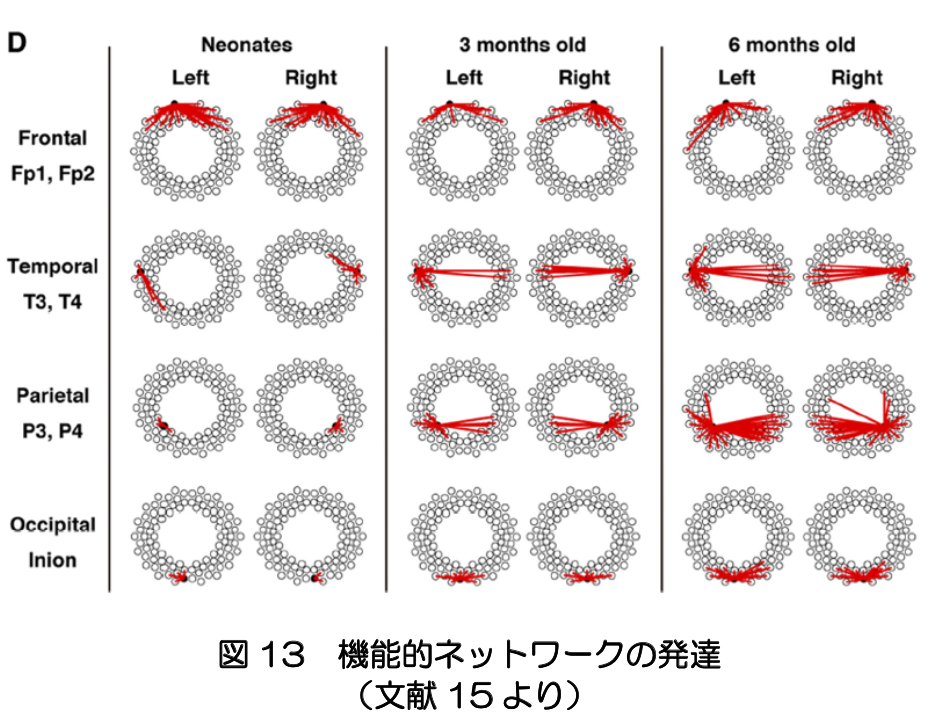 胎児期に配線された白質線維の構造的ネットワークのもとで、生後、活動依存的にシナプス形成や刈り込みが生じ、機能的ネットワークが発達すると考えられる。サブプレートニューロンと皮質ニューロンの交代も機能的ネットワークの発達に寄与すると考えられる。
胎児期に配線された白質線維の構造的ネットワークのもとで、生後、活動依存的にシナプス形成や刈り込みが生じ、機能的ネットワークが発達すると考えられる。サブプレートニューロンと皮質ニューロンの交代も機能的ネットワークの発達に寄与すると考えられる。
脳の初期発達において、最も遅くまで変化が続くのは、白質線維の髄鞘化(ミエリネーション)である。髄鞘化は、有用な機能的ネットワークを固定化、効率化する役割を持つと考えられる。そこで、髄鞘化は可塑性を減らし、発達の感受性期を規定する要因になると考えられる。ただし、連合野等の局所回路は、生涯にわたる変化を可能にするため、髄鞘化が一気に完了しない性質を持つと考えられる。
覚醒した乳児で最も頻繁に見られる行動は、四肢を含む全身の自発運動である。自発運動は、胚子期から乳児期初期にかけて常時生じるが、意図的な運動の獲得時期に消失してゆく(文献16)。乳児の四肢に紐でおもちゃを接続すると、月齢に応じて異なる特徴を持つ運動の変化が見られ、自発運動が意図的運動へと変化する過程を観察することができる(文献17)(図14)。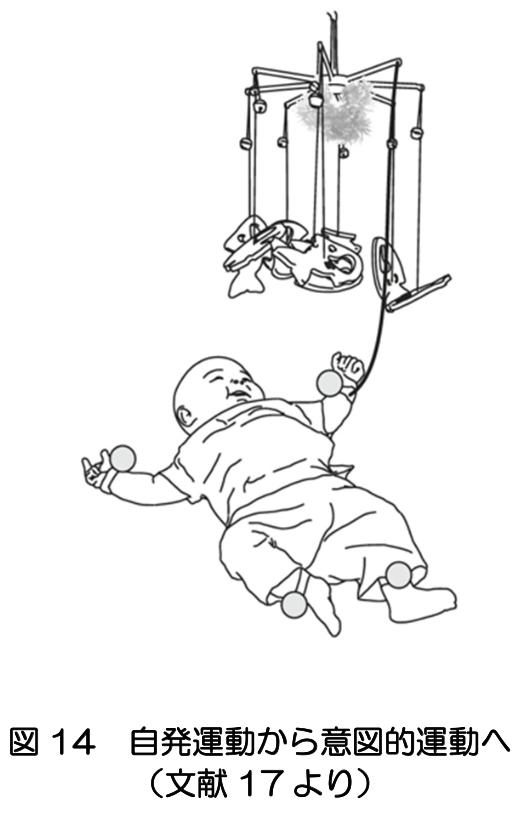 一方、乳児の自発運動の複雑さや流暢さが失われている場合には、脳性麻痺や発達障害の予後と関連することが報告されている(文献16)。ビデオや動作解析システムで計測された乳児の自発運動パターンの分析により、長期的な運動や認知の発達やその障害と相関する証拠が蓄積されている(文献17, 18)。乳児期における自発運動から意図的運動への変化にも、サブプレートニューロンの縮退と皮質ニューロン回路網の成熟が関連していると想定される(文献16)。
一方、乳児の自発運動の複雑さや流暢さが失われている場合には、脳性麻痺や発達障害の予後と関連することが報告されている(文献16)。ビデオや動作解析システムで計測された乳児の自発運動パターンの分析により、長期的な運動や認知の発達やその障害と相関する証拠が蓄積されている(文献17, 18)。乳児期における自発運動から意図的運動への変化にも、サブプレートニューロンの縮退と皮質ニューロン回路網の成熟が関連していると想定される(文献16)。
胎児期に始まった睡眠も生後変化し続ける。睡眠が24時間のサーカディアンリズムに同調して、夜間にまとまってでるようになるとともに、昼間の覚醒が増加する。睡眠と覚醒の機能的役割も分化すると考えられる。例えば、睡眠中の感覚刺激に対する応答(文献19)(図15)や学習の能力は発達にともなって低下し、覚醒時の記憶の固定等に重要な役割を果たすようになると考えられる。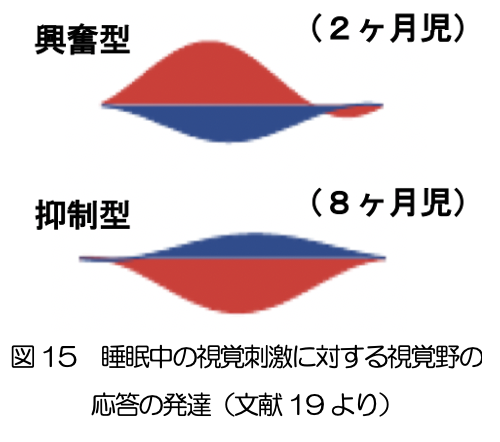
乳児は、物理的および社会的な環境との相互作用を通じて、知覚やコミュニケーションを洗練させると考えられるが、新生児には感覚統合や模倣のような一見高度な能力がすでにあり、それらが一旦失われた後に成熟した機能として出現することがしばしば報告されている。この現象にも、サブプレートの縮退と皮質の成熟が絡んでいる可能性がある。生後3ヶ月ごろには、大脳の感覚野や連合野において、視聴覚、言語、認知機能に関連する脳領域に特化された活動が見られ(図16)、3ヶ月児であれば、成人と同様な体験をしているのではないかと想像される(文献20)。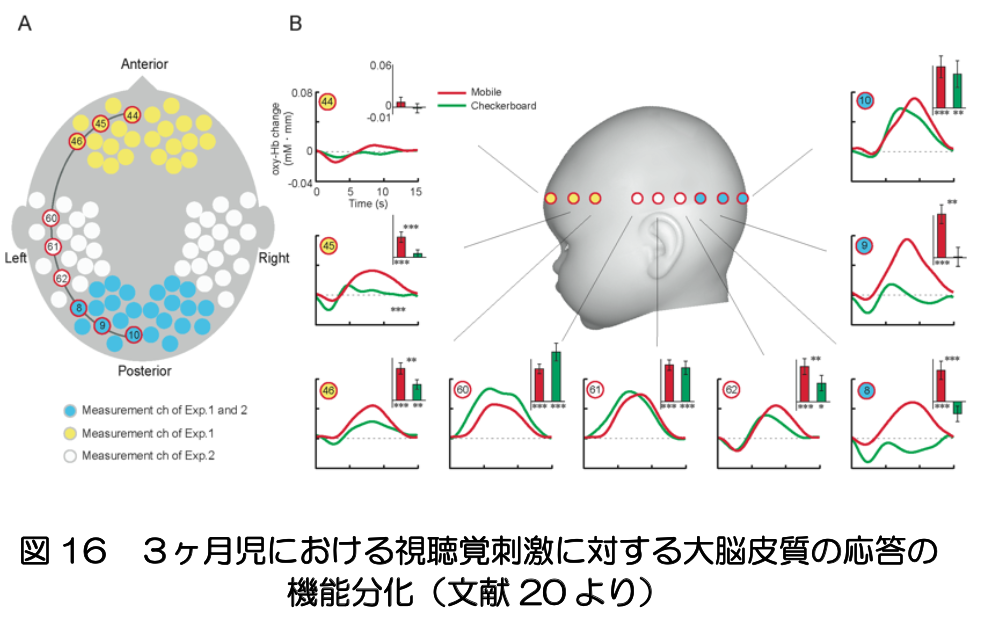 おわりに
おわりに
図17に示すように、胎児期の脳の構造と機能の発達に応じて、自発的な運動や睡眠が組織化され統合される仕組みが明らかになりつつある。生後、乳児は、胎児期の行動を基盤としつつ、それらを環境に適応させるたに再構成し、個体全体としての統合を保ちながら、大脳皮質による高度な機能分化や専門化を実現していくと考えられる。新生児や乳児の内部で起きている劇的な変化や個人ごとの主観的な体験を、今後どこまで捉えられるかは、脳の発達研究の大きな挑戦である。
脳は環境と共生するための念入りな仕組みを備えている。脳の発達に関連する、自発的な形態形成、行動生成、環境との共生について、より深い理解が必要である。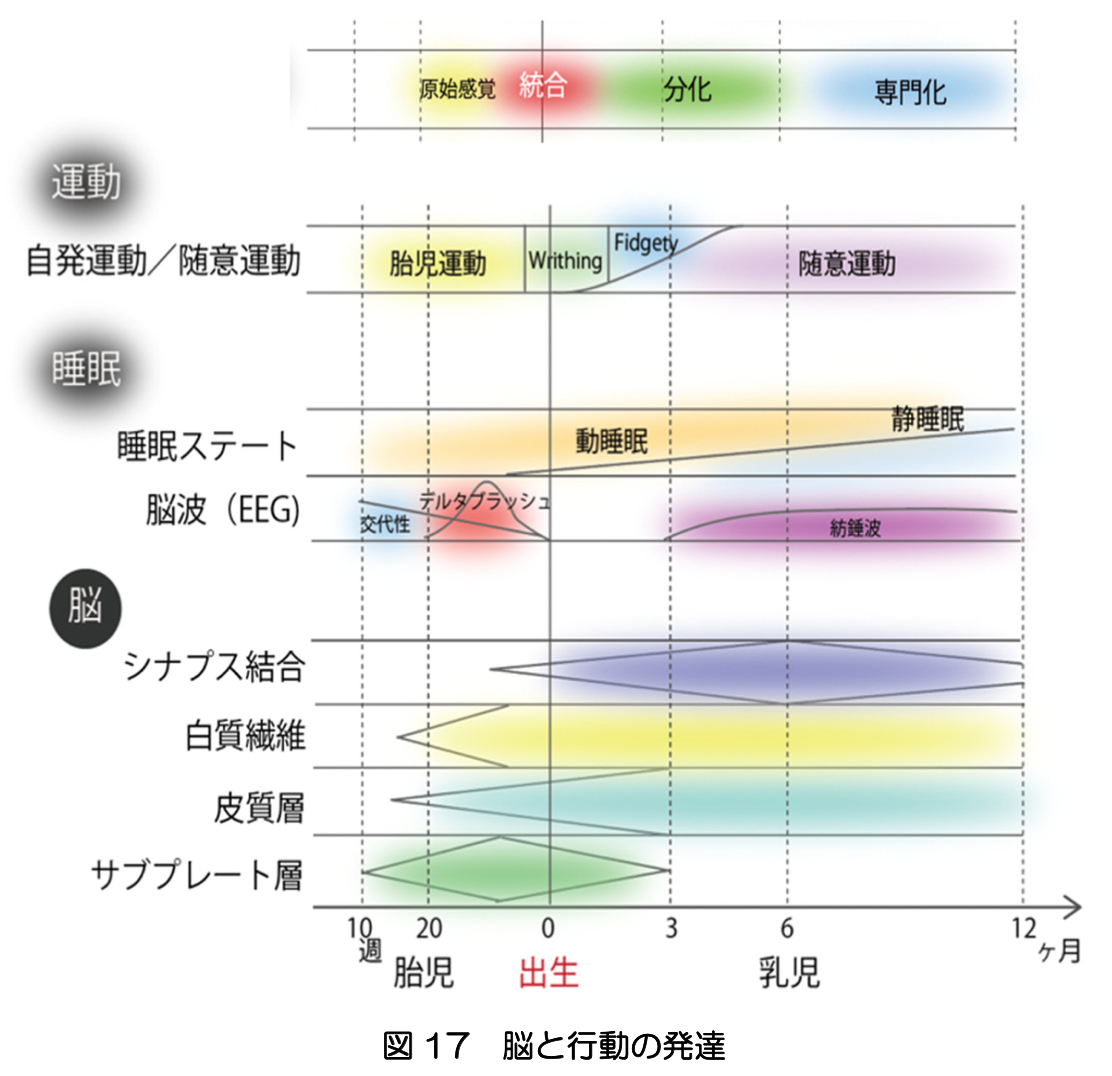
文献
1. O’Rahilly RR, Fabiola M. The embryonic human brain: an atlas of developmental stages. John Wiley & Sons; 2006.
2. Honda H. The world of epithelial sheets. Development, Growth & Differentiation. 2017; 59: 306-316.
3. Morelli LG, Uriu K, Ares S, et al. Computational approaches to developmental patterning. Science, 2012; 336:187-191.
4. Yamaguchi Y, Miyazaki R, Kamatani M, et al. Three‐dimensional models of the segmented human fetal brain generated by magnetic resonance imaging. Congenital Anomalies. 2018; 58: 48-55.
5. Ishikawa Y, Yamamoto N, Yoshimoto M, et al. The primary brain vesicles revisited: are the three primary vesicles (forebrain/midbrain/hindbrain) universal in vertebrates. Brain, Behavior and Evolution. 2012; 79: 75-83.
6. Hayat TT, Rutherford MA. Neuroimaging perspectives on fetal motor behavior. Neuroscience & Biobehavioral Reviews. 2018; 92: 390-401.
7. Kostovic I. The enigmatic fetal subplate compartment forms an early tangential cortical nexus and provides the framework for construction of cortical connectivity. Progress in Neurobiology. 2020; 101883.
8. Ohtaka-Maruyama C, Okamoto M, Endo K, et al. Synaptic transmission from subplate neurons controls radial migration of neocortical neurons. Science. 2018; 360: 313-317.
9. Molnár Z, Luhmann HJ, Kanold PO. Transient cortical circuits match spontaneous and sensory-driven activity during development. Science, 2020; 370: eabb2153.
10. Kidokoro H. Delta brushes are not just a hallmark of EEG in human preterm infants. Pediatrics International. 2021; 63: 130-136.
11. Huang H, Xue R, Zhang J, et al. Anatomical characterization of human fetal brain development with diffusion tensor magnetic resonance imaging. Journal of Neuroscience. 2009; 29: 4263-4273.
12. Van Essen DC. A 2020 view of tension-based cortical morphogenesis. Proceedings of the National Academy of Sciences. 2020: 117: 32868-32879.
13. Wallois F, Routier L, Heberlé C, et al. Back to basics: the neuronal substrates and mechanisms that underlie the electroencephalogram in premature neonates. Neurophysiologie Clinique. 2020; 51: 5-33.
14. Watanabe H, Shitara Y, Aoki Y, et al. Hemoglobin phase of oxygenation and deoxygenation in early brain development measured using fNIRS. Proceedings of the National Academy of Sciences. 2017; 114: E1737-E1744.
15. Homae F, Watanabe H, Otobe T, et al. Development of global cortical networks in early infancy. Journal of Neuroscience. 2010; 30: 4877-4882.
16. Hadders-Algra M. Neural substrate and clinical significance of general movements: an update. Developmental Medicine and Child Neurology. 2018; 60: 39-46.
17. Watanabe H, Homae F, Taga G. Developmental emergence of self-referential and inhibition mechanisms of body movements underling felicitous behaviors. Journal of Experimental Psychology. Human Perception and Performance. 2011; 37: 1157-1173.
18. Gima H, Kihara H, Watanabe H, et al. Early motor signs of autism spectrum disorder in spontaneous position and movement of the head. Experimental Brain Research. 2018; 236: 1139-1148.
19. Taga G, Watanabe H, Homae F. Developmental changes in cortical sensory processing during wakefulness and sleep. NeuroImage, 2018; 178: 519-530.
20. Taga G, Asakawa K, Maki A, et al. Brain imaging in awake infants by near-infrared optical topography. Proceedings of the National Academy of Sciences. 2003; 100: 10722-10727.
#本ページの内容は、以下に加筆し、図を追加したものである。
#多賀厳太郎 脳の発達. Clinical Neuroscience, 40, 300-303, 2021.
